图源:华盛顿大学蛋白质设计研究所
编辑丨coisini
在疾病的预防和治疗中,抗体药物发挥着至关重要的作用。作为一种蛋白质治疗剂,全球现有超过 160 种抗体药物获批,其市场价值预计在未来 5 年内将达到 4450 亿美元。
以往,抗体发现主要依赖于免疫接种、随机库筛选或直接从患者体内分离抗体。现在,诺贝尔奖得主大卫・贝克实验室和华盛顿大学蛋白质设计研究所(IPD)的研究人员运用人工智能技术实现了从头开始设计抗体,为领域带来了颠覆性突破。
研究论文以《Atomically accurate de novo design of antibodies with RFdiffusion》为题发表在《Nature》上。

论文地址:https://www.nature.com/articles/s41586-025-09721-5
开源地址:https://github.com/RosettaCommons/RFantibody
论文作者之一、IPD 电子显微镜研发负责人 Andrew Borst 表示:「这曾是真正的宏大挑战 —— 如同天方夜谭。」如今该研究设计出能成功结合靶标的抗体,将为抗体药物行业注入强劲动力。
从头设计抗体
一个理想的从头设计抗体方法应能够:(1)靶向任何感兴趣目标上的任何指定表位;(2)将采样集中在互补决定区(CDR)环上,保持框架序列和结构接近用户指定的高度优化的治疗性抗体框架;以及(3)采样设计抗体相对于表位的替代刚体位置。
为了开发出理想的从头设计抗体方法,研究团队首先假设:一个在抗体结构上微调的 RFdiffusion 变体能够设计从头 CDR 介导界面。
该研究主要在抗体复合物结构上对 RFdiffusion 进行了微调。为了允许在推理时指定框架结构和序列,在训练期间,该研究将框架序列和结构作为条件输入提供给 RFdiffusion。
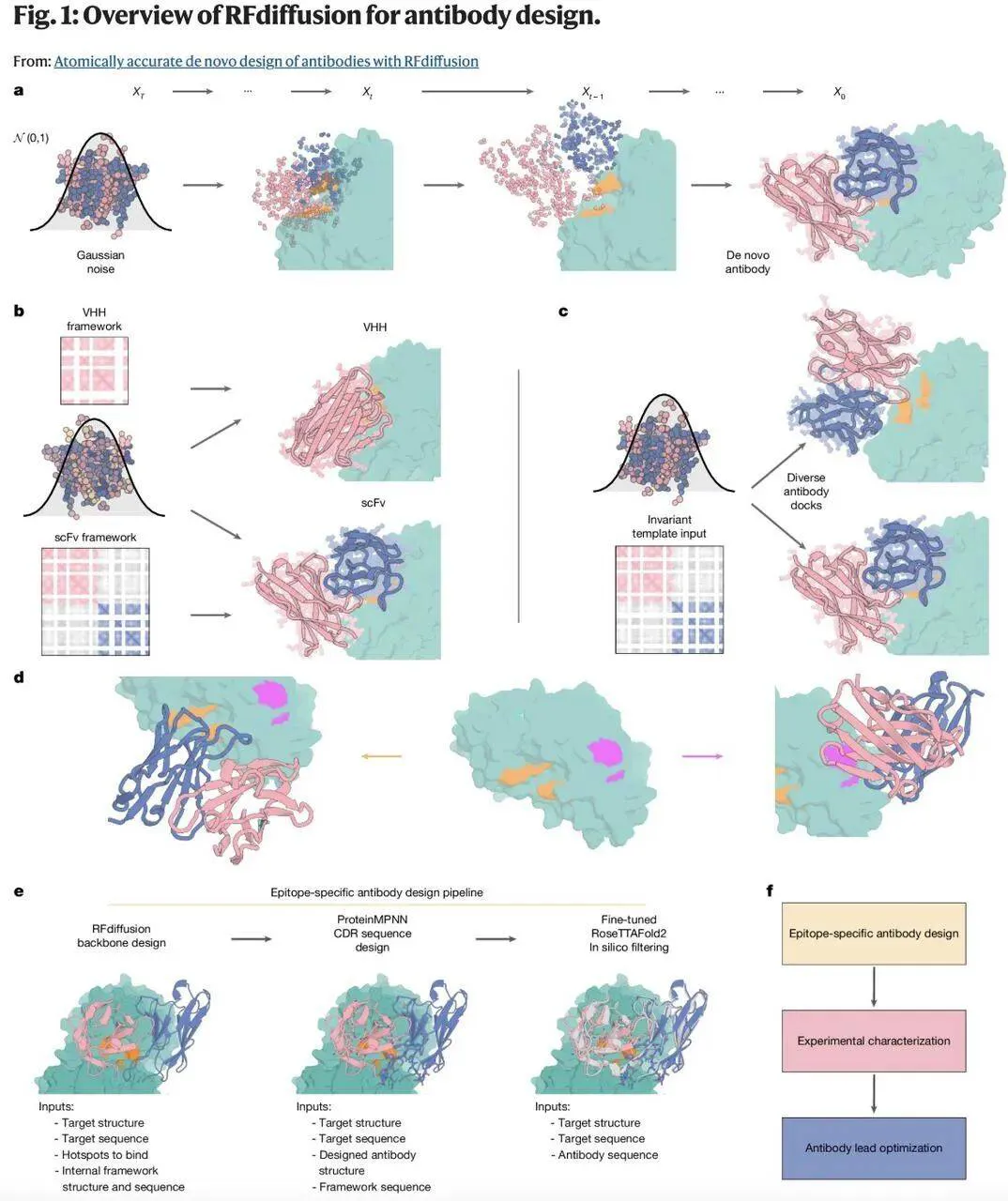
通过这种训练,RFdiffusion 能够设计出与输入框架结构高度匹配、并通过新型 CDR 环靶向指定表位的抗体结构。
接下来,该研究使用 ProteinMPNN 来设计 CDR 环序列。所设计的抗体与目标表位之间形成了多样化的相互作用,并且与训练数据集中的序列存在显著差异,训练数据集相似性与结合成功率之间不存在相关性。
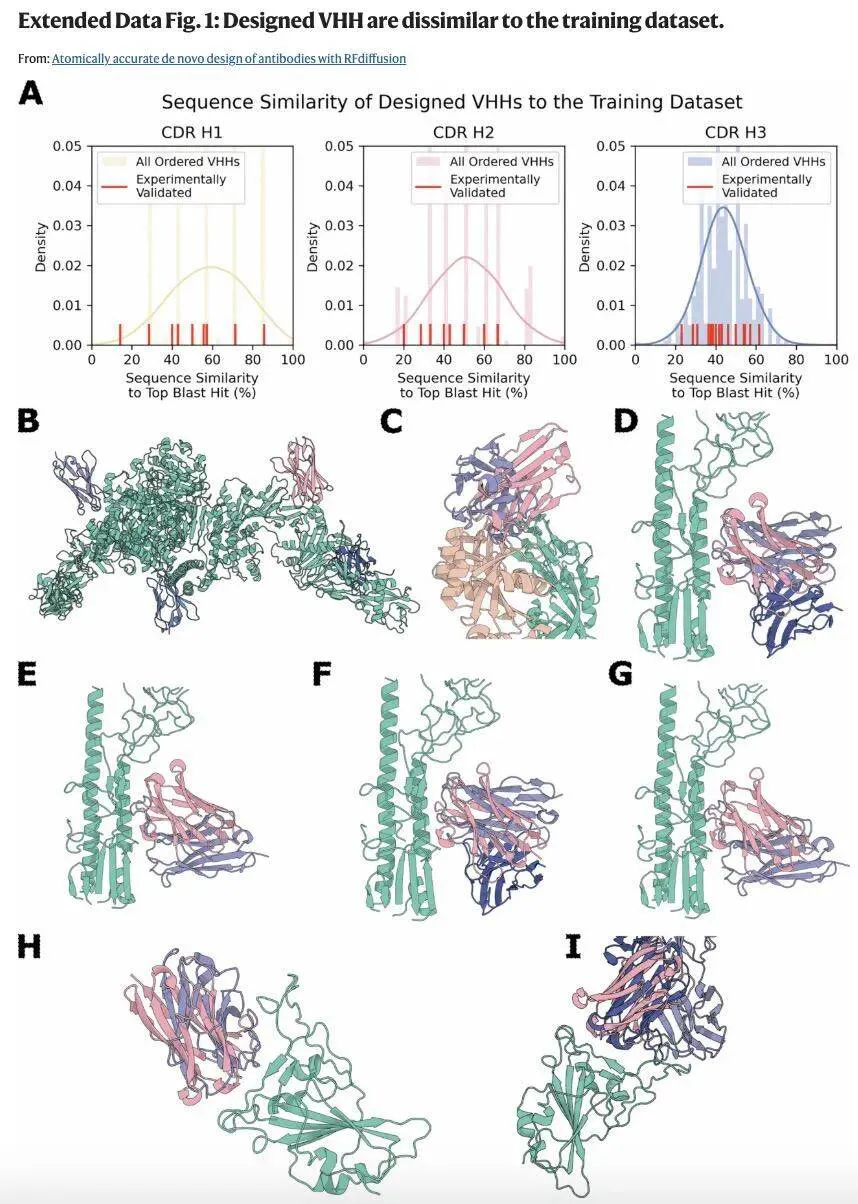
研究团队重点关注抗体臂上六个发挥「捕获手指」功能的蛋白环。论文作者之一、IPD 博士后研究员 Robert Ragotte 介绍道:「我们完全从头设计所有六个环,并保留抗体其余部分 —— 即框架结构的完整性。」
通过维持抗体大部分与人体自身蛋白的相似性,所设计的抗体有望避免患者免疫系统将药物视为外来物质而产生排异反应。
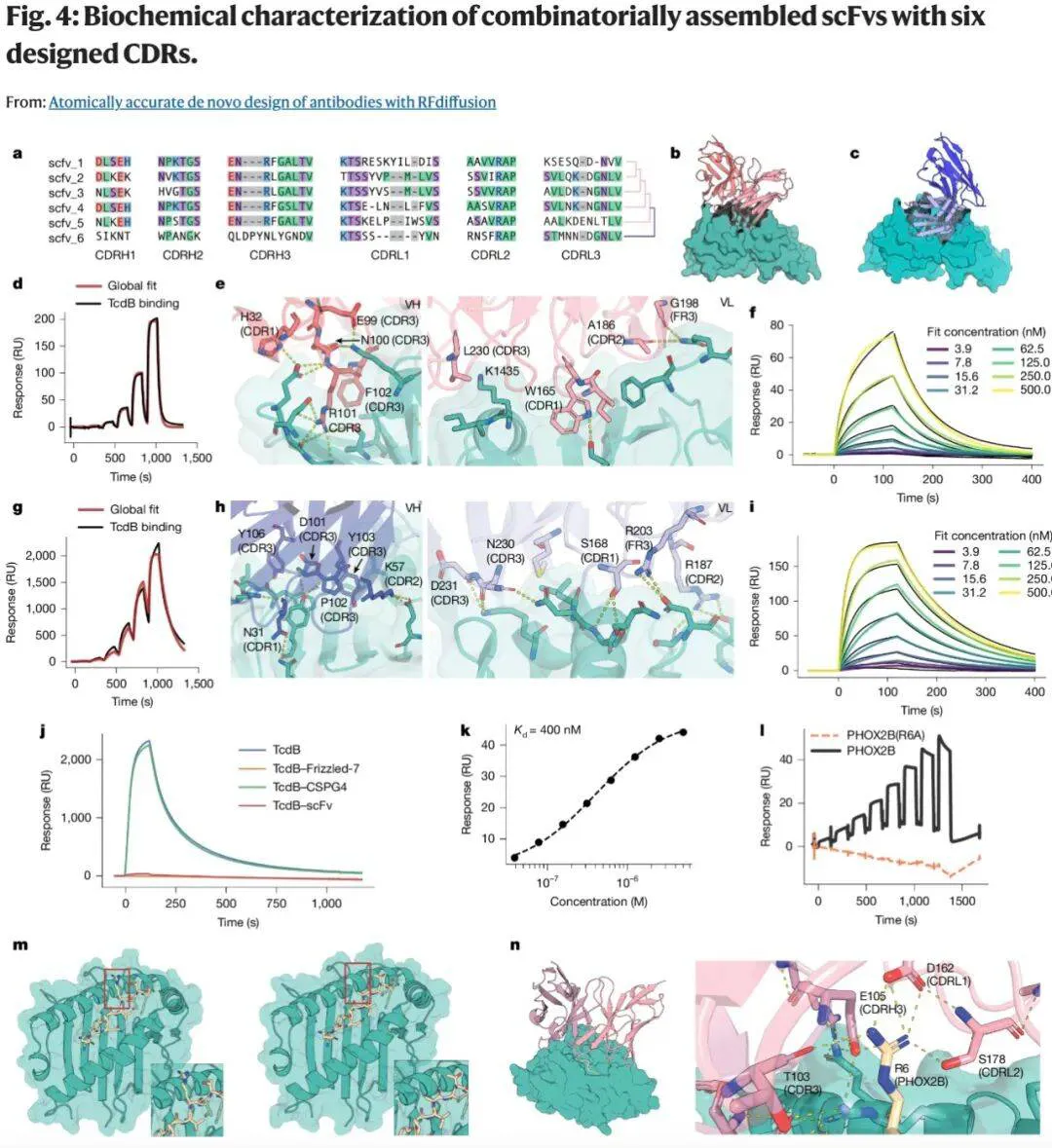
实验与应用
研究团队针对多种真实靶点测试了所设计的抗体,包括流感病毒侵染宿主细胞的关键蛋白血凝素、艰难梭菌(C. difficile)产生的强效毒素等。实验结果显示,大多数情况下新型抗体均能如模拟预测般精准结合靶标。
例如,该研究通过冷冻电镜结构解析来评估抗体设计的准确性:将设计的抗血凝素 VHH 与天然糖基化的三聚体流感血凝素糖蛋白形成复合物后进行结构测定。冷冻电镜数据处理显示,在四个测试样本中,有一种 VHH 设计能有效结合至完全糖基化的血凝素三聚体。
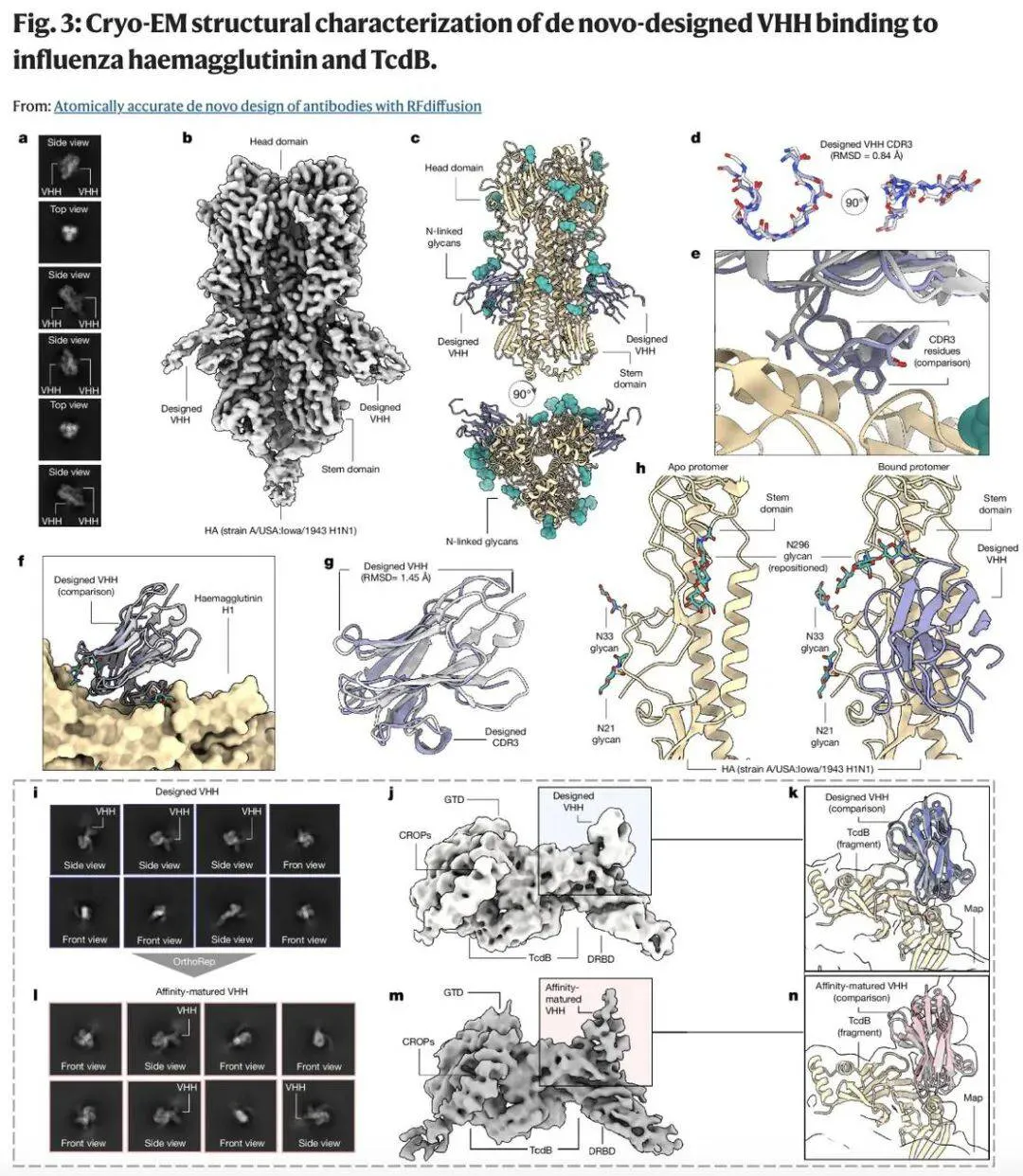
Andrew Borst 指出:「所设计的抗体以正确的构型精准结合目标位点,可能会产生治疗效应。」
目前,研究团队已将设计抗体的软件开源。而由华盛顿大学 IPD 校友创立的生物技术公司 Xaira Therapeutics 已获得部分技术的商业应用许可,研究论文的多位作者目前就职于该公司。

Andrew Borst 与 Robert Ragotte
尽管该研究在抗体设计方面取得了里程碑式突破,但开发成治疗方法仍任重道远。候选药物还需优化溶解度、靶标亲和力等特性,并最大限度降低可能引发不良免疫反应的免疫原性。
参考内容:https://www.geekwire.com/2025/nobel-winners-lab-notches-another-breakthrough-ai-designed-antibodies-that-hit-their-targets/