编辑丨coisini
复杂疾病的诱发因素往往是多元的,而传统的药物发现方法侧重于激活或抑制单一蛋白质。当疾病由多种信号通路和基因相互作用推动时,这种药物发现模式可能就不够用了。
最近,来自哈佛医学院、帝国理工学院等的研究团队设计出一种名为 PDGrapher 的人工智能模型,将重点放在疾病的多种驱动因素上,并识别最有可能使病变细胞恢复健康功能的基因。这项研究有望重塑药物研发格局。
PDGrapher 模型已开源,可免费使用。研究论文以《Combinatorial prediction of therapeutic perturbations using causally inspired neural networks》为题发表在《Nature Biomedical Engineering》上。

论文地址:https://www.nature.com/articles/s41551-025-01481-x
开源地址:https://github.com/mims-harvard/PDGrapher
PDGrapher 的工作原理:
绘制复杂关联与效应图谱
PDGrapher 基于图神经网络(GNN),不仅关注单个数据点,更着眼于数据点之间的相互关联及影响。
与传统方法需要穷尽大型药物数据库中的化合物进行测试不同,PDGrapher 专注于最有可能逆转疾病的药物组合。PDGrapher 采用因果模型构建,其中基因代表因果图中的节点,结构因果方程(structural causal equations)则定义基因间的因果关系。
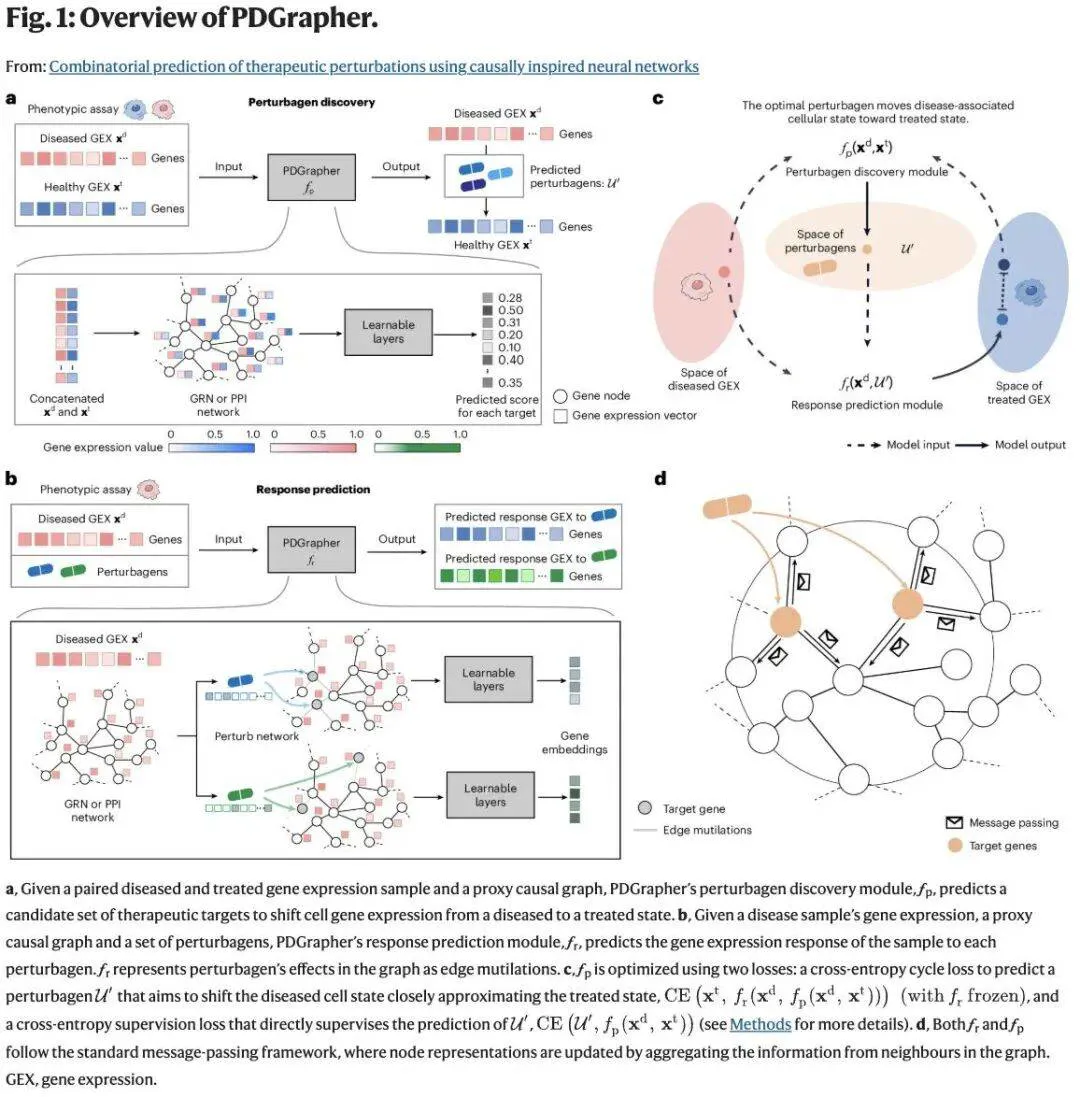
给定遗传或化学干预数据集,PDGrapher 能精准识别扰动剂应靶向的基因集合,促使基因表达从病变转向治疗态。
PDGrapher 以蛋白质相互作用网络(PPI)或基因调控网络(GRN)作为因果图的近似表征,其运作基于「无未观测混杂因素」的假设。模型首先定位可能驱动疾病的细胞组成部分,随后模拟这些组分被关闭或抑制时产生的效应,并据此判断:若特定靶点被「击中」,病变细胞是否会发生逆转。
优势显著
研究团队使用治疗前后病变细胞的数据集对 PDGrapher 进行训练,使其学会识别哪些基因靶点能将细胞从病变状态转化为健康状态。
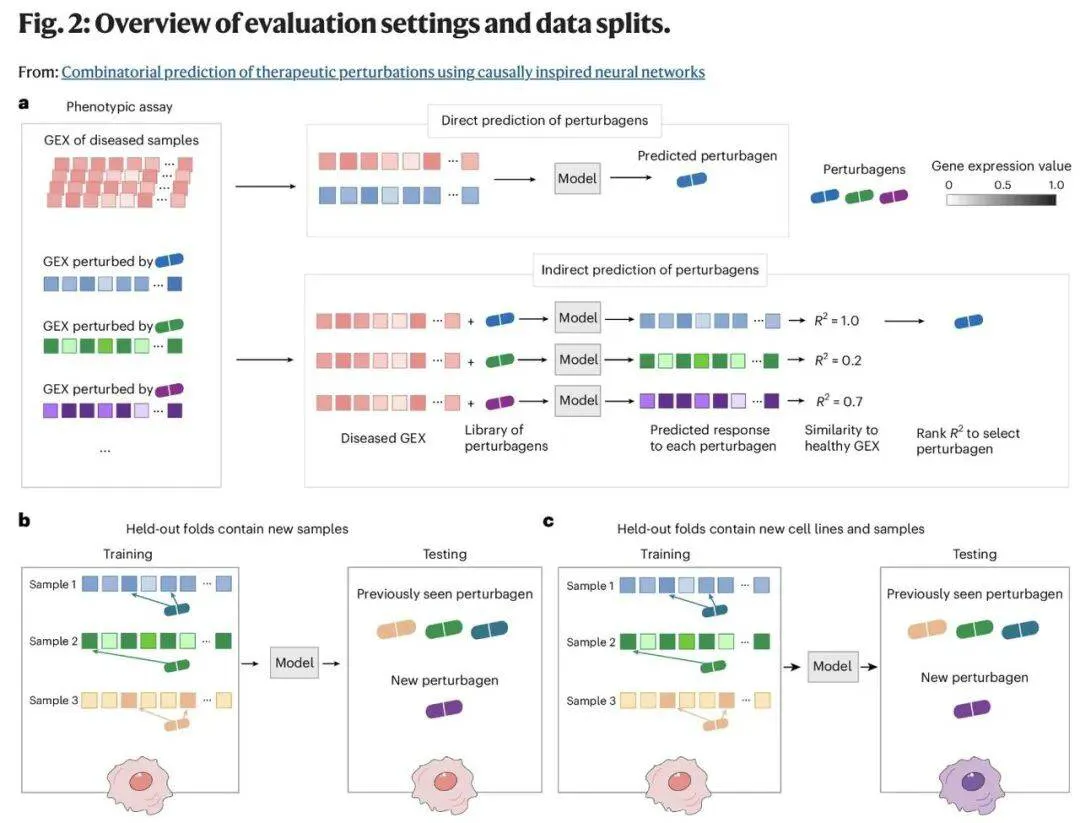
在实验测试中,研究团队采用基因和药物实验两种方式,在涵盖 11 种癌症的 19 个数据集上验证了模型性能 —— 要求其为从未接触过的细胞样本和癌症类型预测多种治疗方案。
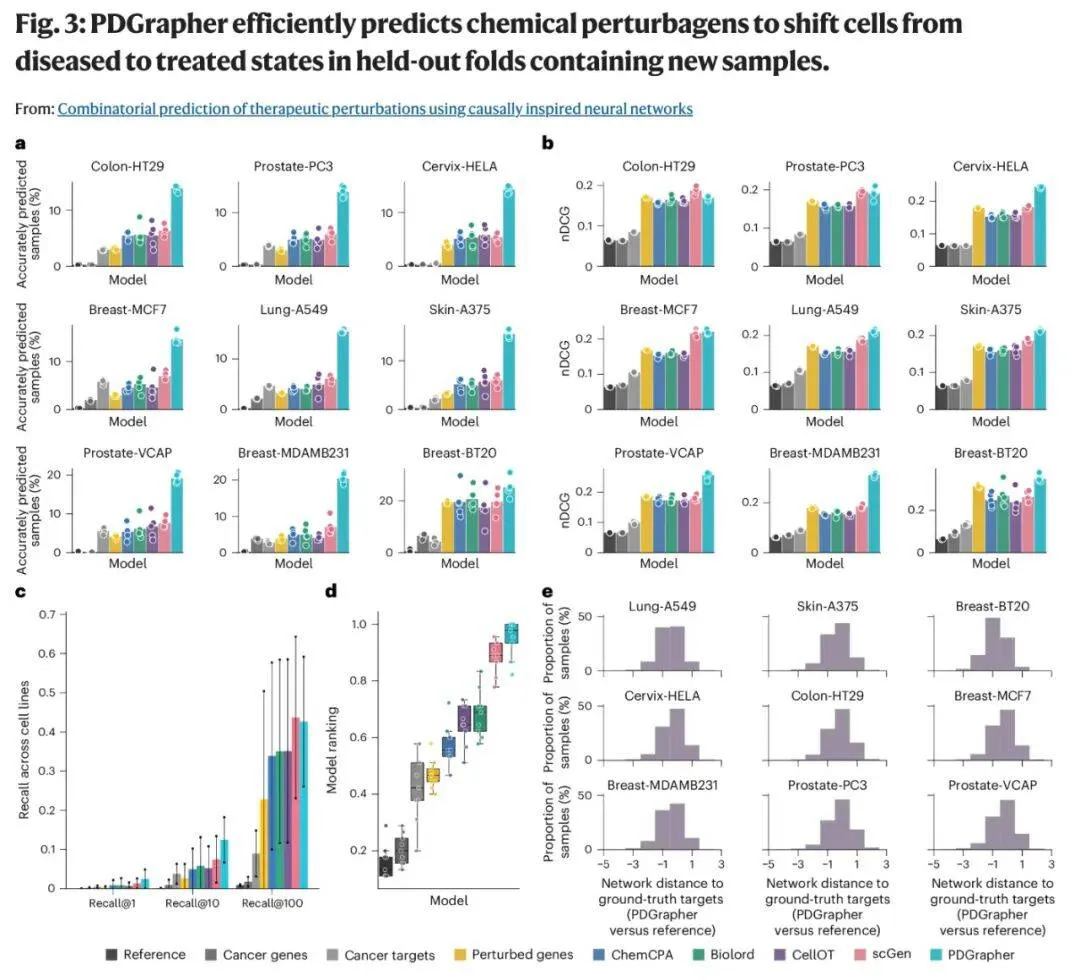
测试结果显示:PDGrapher 准确预测了已知有效的药物靶点(数据在训练阶段刻意排除),同时发现了新证据支持的其他候选靶点。
与同类工具相比,PDGrapher 展现出卓越的准确性与效率:在未见过数据集中,其正确治疗靶点排序比其他模型提升高达 35%,处理速度比同类 AI 方法快 25 倍。
AI 突破预示医学未来
研究团队表示,PDGrapher 能优化新药研发模式。由于 PDGrapher 无需先预测每个可能变化对细胞的影响再寻找有效药物,而是直接寻找能逆转疾病特征的特定靶点,显著加速了理念验证过程,使研究人员能聚焦于更少但更具潜力的靶点。
PDGrapher 对多通路驱动的复杂疾病(如癌症)尤为有用。经过严谨验证后,PDGrapher 未来或还可用于分析患者细胞图谱,助力设计个体化联合治疗方案。
研究团队表示:「我们的终极目标是绘制清晰的路线图,揭示在细胞层面逆转疾病的所有可能途径。」
参考内容:https://medicalxpress.com/news/2025-09-ai-tool-genes-drug-combos.html