编辑丨coisini
染色体是遗传物质的载体,对基因遗传和健康起着重要作用。很多疾病的发生就是染色体异常导致的。
某些侵袭性极强癌症的主要驱动因素就是染色体异常。如果能够观察分析染色体异常及其原因,癌症的治疗就会迎来新突破。
然而,在任意给定时间,只有一小部分分裂细胞会表现出明显的染色体缺陷,且这类细胞通常在被分析之前就已死亡。传统上,科学家必须借助显微镜手动识别,研究过程缓慢艰苦。
基于此,海德堡欧洲分子生物学实验室开发了一种新型人工智能平台 ——MAGIC,旨在用机器学习辅助基因组学。通过整合微核细胞活体成像、实时机器学习与单细胞基因组学技术,MAGIC 能够让科学家系统研究癌症形成过程,追踪细胞分裂过程中诱发肿瘤的自发性错误(染色体异常)是如何产生的。
研究论文以《Origins of chromosome instability unveiled by coupled imaging and genomics》为题发表于《Nature》上。

论文地址:https://www.nature.com/articles/s41586-025-09632-5
异常细胞的「激光标记」系统
近期,有研究证实:单个 DNA 损伤即可引发一系列改变,导致染色体不稳定,并促进复杂癌症的形成。
细胞分裂时,DNA 片段脱落会形成额外小型细胞核 —— 微核。微核不仅是细胞残骸,更是危险信号。携带微核的细胞更容易产生新的染色体异常,并可能最终转化为癌细胞。
MAGIC 系统旨在通过研究核异型性来深入理解癌症形成机制。该系统集成了活细胞自主共聚焦显微镜、核异型性实时评估机器学习系统、靶向细胞光标记及分选技术。
MAGIC 的运行机制类似于微观层面的激光标签游戏。它通过自动显微镜技术和经训练可识别微核特征的人工智能算法,对数千个细胞进行扫描。
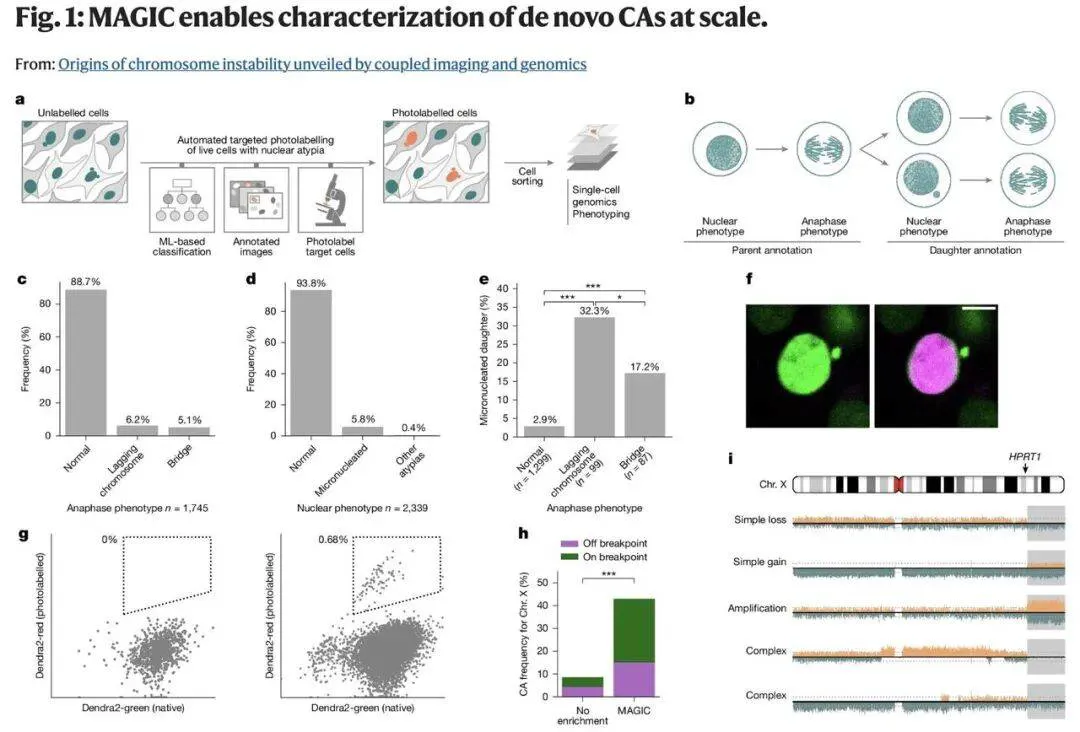
当 AI 识别出含微核的细胞后,会指导显微镜使用光转换染料进行「标记」—— 这种荧光分子在激光照射下会改变颜色。基于光学的标记使研究人员能通过流式细胞术(flow cytometry)追踪和分离特定细胞,随后对分离细胞进行单细胞测序和系统表型分析,从而在模拟肿瘤演化早期阶段的细胞系模型中,深入研究细胞微环境、突变率及自发染色体畸变的形成诱因。
通过实现图像捕获到基因分析的全流程自动化,MAGIC 消除了人工选择的需求,极大加快了研究速度,让科学家在一天内即可分析近 10 万个细胞。
实时追踪染色体错误
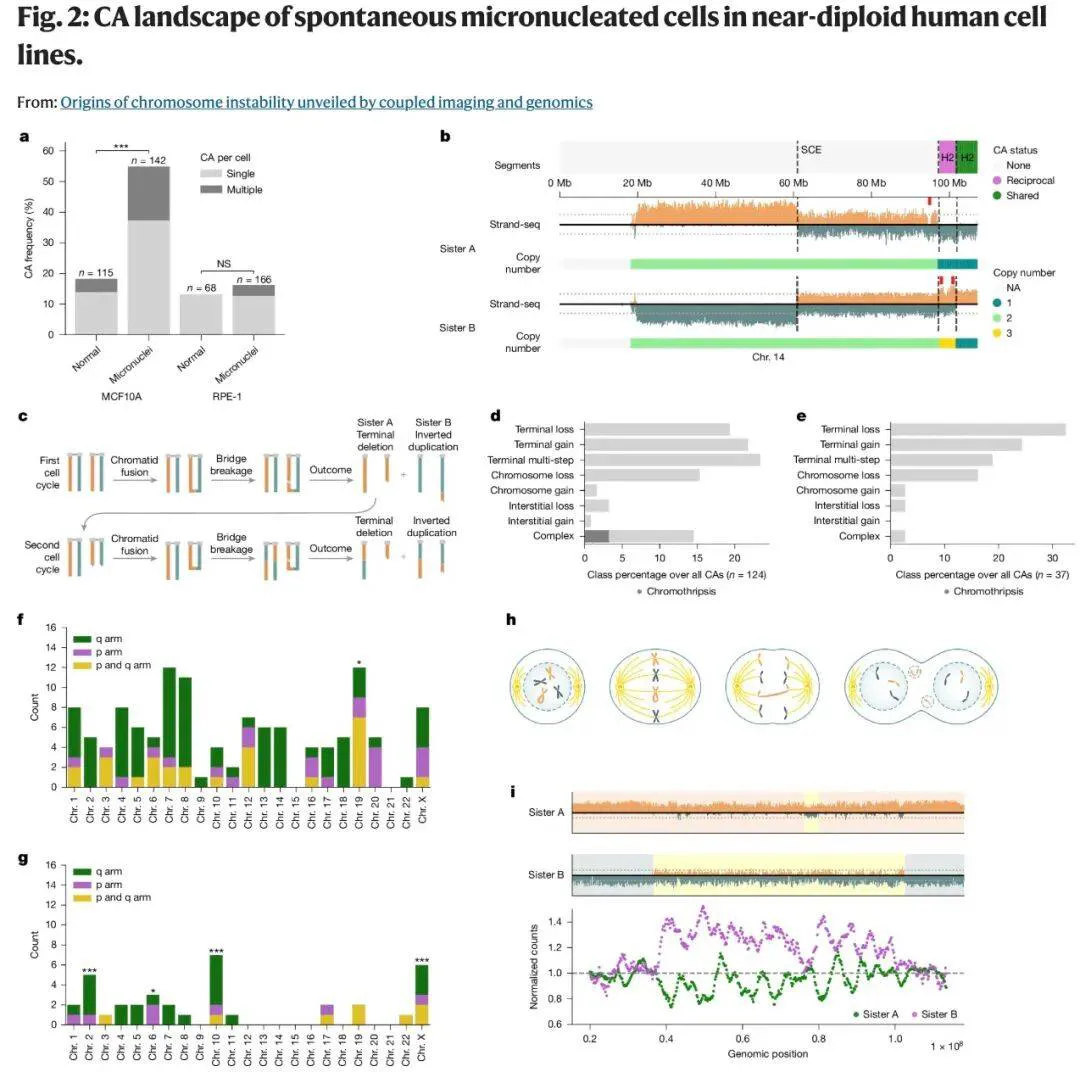
研究团队运用 MAGIC 监测培养人类细胞的染色体异常。他们发现超过 10% 的正常细胞分裂会产生某种自发性染色体改变。
例如,当 TP53 基因(编码 p53 肿瘤抑制蛋白)被抑制后,异常率几乎翻倍,这印证了 p53 在维持基因组稳定性中的关键作用。
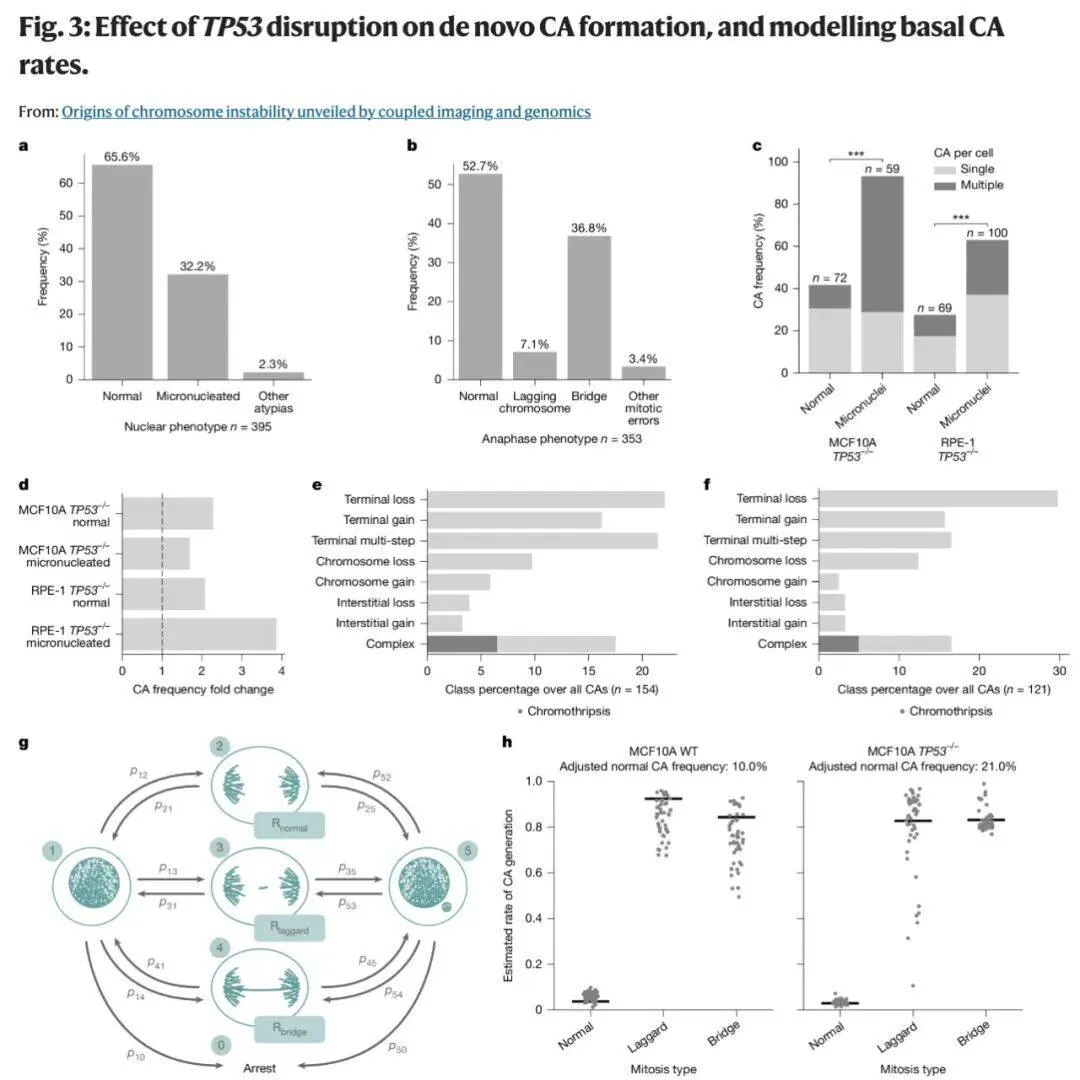
研究团队还精准定位了这些异常背后的特定机制。一个重要诱因是双着丝粒染色体,这种不稳定结构在细胞分裂时会被双向拉扯,导致染色体断裂和重排。
MAGIC 实现了每次实验对数万个细胞的自动化分析,能够大规模分离稀有细胞形态,从而突破了核异型性研究的局限。
研究团队累计分离了 2898 个单细胞,并对 2192 个单细胞基因组进行测序,构建出研究新发癌症的空前数据集。
MAGIC 的人工智能算法可通过再训练识别几乎所有可见细胞特征,因此 MAGIC 的应用不仅限于癌症相关异常研究,它还能应用于神经退行性病变、衰老、遗传疾病等诸多生物学问题的探索。
感兴趣的读者可以阅读论文原文,了解更多研究内容。
参考内容:https://www.insideprecisionmedicine.com/topics/oncology/like-magic-new-ai-tool-reveals-how-chromosomal-errors-arise-offers-clues-to-cancers-origins/