编辑丨&
在过去的时间里,我们见证了许多医学大模型的涌现,它们在各自的领域都有着独特的功效。但即使有大模型的介入,传统癌症免疫治疗的周期也足以令研究者头痛。
丹麦技术大学(Technical University of Denmark,DTU)打破常规,首次使用 RFdiffusion+ProteinMPNN+AlphaFold2 三步 AI 流水线,从 5500 种蛋白骨架设计出 44 款 pMHC 微型结合蛋白(mini binder,miBd),并在短短数周内完成体外高通量筛选和结构验证。
该研究以「De novo–designed pMHC binders facilitate T cell–mediated cytotoxicity toward cancer cells」为题,于 2025 年 7 月 24 日刊登在《Science》。

原文链接:https://www.science.org/doi/10.1126/science.adv0422
AI三步法
T 细胞是一种免疫细胞,能够对细胞内抗原做出反应。CD8+T 细胞通过其 T 细胞受体(TCR)识别抗原,该受体与所有有核细胞上的主要组织相容性复合体I类(pMHC - I)呈递的肽相结合。而癌细胞就在此类上就展示出可被肿瘤 T 细胞识别的抗原。
基于这个原理,DTU 的研究者提出了一种猜想:能不能利用这种表达,定制出能够大规模生产乃至武装到免疫细胞上的蛋白质组件,从而实现规模化的精准癌症治疗呢?
研究团队首先首先利用 RFdiffusion 生成 5500 种潜在 pMHC 结合骨架,再通过 ProteinMPNN 为每个骨架设计界面残基序列,最后用 AlphaFold2 预测折叠稳定性与结合模式。
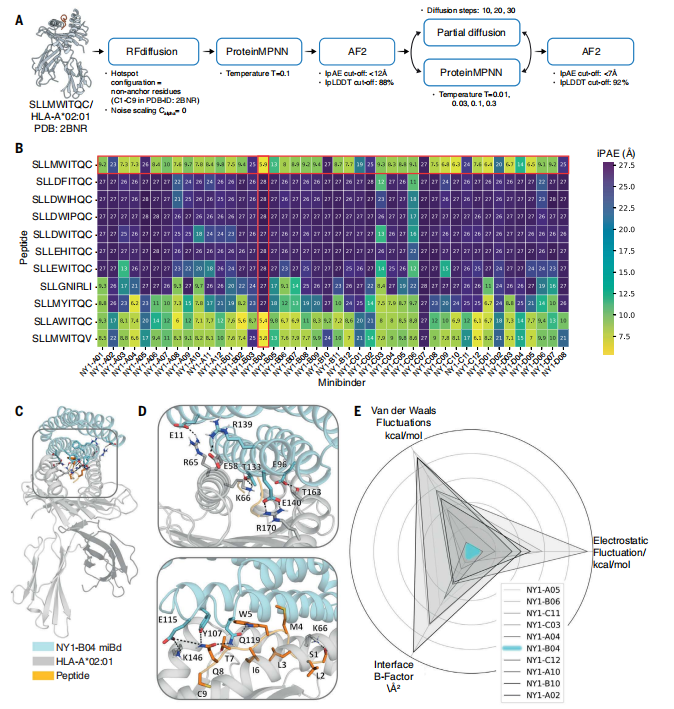
图 1:针对呈递于 pMHC 上的 miBd 设计以及利用分子动力学(MD)模拟的构象多样性评估器筛选。(图源:论文)
对 44 款候选 miBd 进行表面等离子共振(SPR)测定,团队发现其中一种复合物的解离常数(Kd)仅为 6.9 nM,界面 RMSD 在 1.8 Å 分辨率的 X 射线晶体学结构中得到验证。整个流程从设计到结构确定,用时仅需 4~6 周,大幅缩短了传统抗体工程的数月甚至数年周期。
接着团队在一种广为人知的癌症靶标 NY-ESO-1 上测试了他们的所得成果。当设计的蛋白质被插入 T 细胞时,研究人员将其命名为「IMPAC-T」细胞,这种细胞在实验室实验中能够有效引导 T 细胞杀死癌细胞。
测试通过对黑色素瘤细胞应用改造后的免疫细胞确认其杀伤能力。在与 NY1-B04 IMPAC-T 细胞接触 24 小时后,与未转导的对照组相比,IMPAC-T 条件下色素瘤细胞的死亡率更高。这为 miBds 是否适用于基于细胞的疗法提供了原理证明。
功能验证
研究人员的另一个关键创新步骤是开发了一种「虚拟安全检查」,利用 AI 筛选他们设计的小分子抑制剂,并评估其与健康细胞表面的 pMHC 分子的相互作用。这种方法使他们在进行任何实验之前就能筛选出可能导致危险副作用的小分子抑制剂。
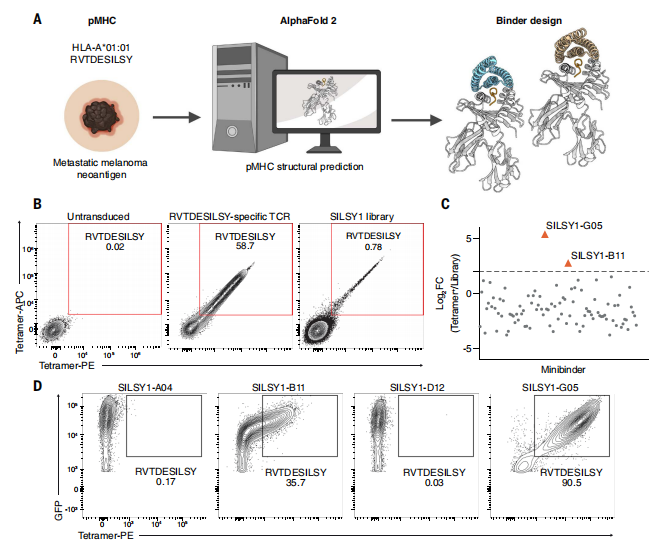
图 2: 将设计流程应用于新抗原的概念验证。(图源:论文)
除开上述的对黑色素瘤进行验证之外,针对结构未知的新抗原 pMHC 也同样需要进行验证。尤其是在目前,pMHC-I 的晶体结构很少能获得,这无疑是一种潜在的实验缺陷。
因此,团队试图通过靶向源自转移性黑色素瘤中鉴定出的新抗原,进一步测试方法的局限性。由于不存在实验结构,他们使用 AF2 对 pMHC - I 复合物进行建模。根据 AF2 选择最可靠的结构后,使用先前的流程设计了 miBd。
96 个单链抗体中,团队发现了 2 种有效结合剂(SILSY1-B11 和 SILSY1-G05),成功率约 2%,证明该平台对未知结构抗原的适用性。
还有 5 年
DTU 的研究员 Kristoffer Haurum Johansen 博士表示,新方法在准备进行初步临床试验需要五年左右的时间。一旦方法准备好,治疗过程将类似于目前用于治疗淋巴瘤和白血病的基因修饰 T 细胞(CAR-T 细胞)的治疗方法。
患者首先会在医院抽血,类似于常规血液检查。然后从血液样本中提取免疫细胞,并在实验室中对其进行修改,使其携带 AI 设计的小分子配体,并重新注入回身体。
这种方法就如同精确制导的导弹一般,不仅将助力肿瘤精准治疗,也有望延伸至传染病、疫苗开发等多种免疫应用,为生物医药开辟全新路径。