编辑丨coisini
随着分子生物学、结构生物学、组合化学及人工智能(AI)技术的进步,药物研发范式已从随机筛选转向理性药物设计。
理性药物设计主要包括两种策略:基于配体的药物设计(LBDD)和基于结构的药物设计(SBDD)。其中,SBDD 因现有分子生成模型常忽略结构可行性与类药性,会产生不真实的三维分子。
为了解决这个问题,来自华东师范大学人工智能新药创智中心、临港实验室的研究团队提出了一种整合键扩散与属性引导的靶向条件 E (3) 等变扩散模型 ——DiffGui。通过结合原子扩散与键扩散,DiffGui 能够显式建模原子与键的相互依赖关系,确保二者协同生成。属性引导机制则将分子的结合亲和力与类药性融入训练与采样过程。
研究论文以《Target-aware 3D molecular generation based on guided equivariant diffusion》为题发表在《Nature Communications》上。

论文地址:https://www.nature.com/articles/s41467-025-63245-0
方法概览
当前,扩散模型易产生结构扭曲的非现实分子(如三 / 四元环、超大环、稠环),这些分子能量不稳定且合成困难。
受无分类器扩散引导的启发,研究团队提出新型引导扩散模型 DiffGui,可为任意给定蛋白质靶点生成配体分子。
通过将键扩散和属性引导整合到扩散过程中,DiffGui 能够同步生成分子中的原子和化学键,所生成的分子既具有高度结构合理性,又具备理想分子特性。
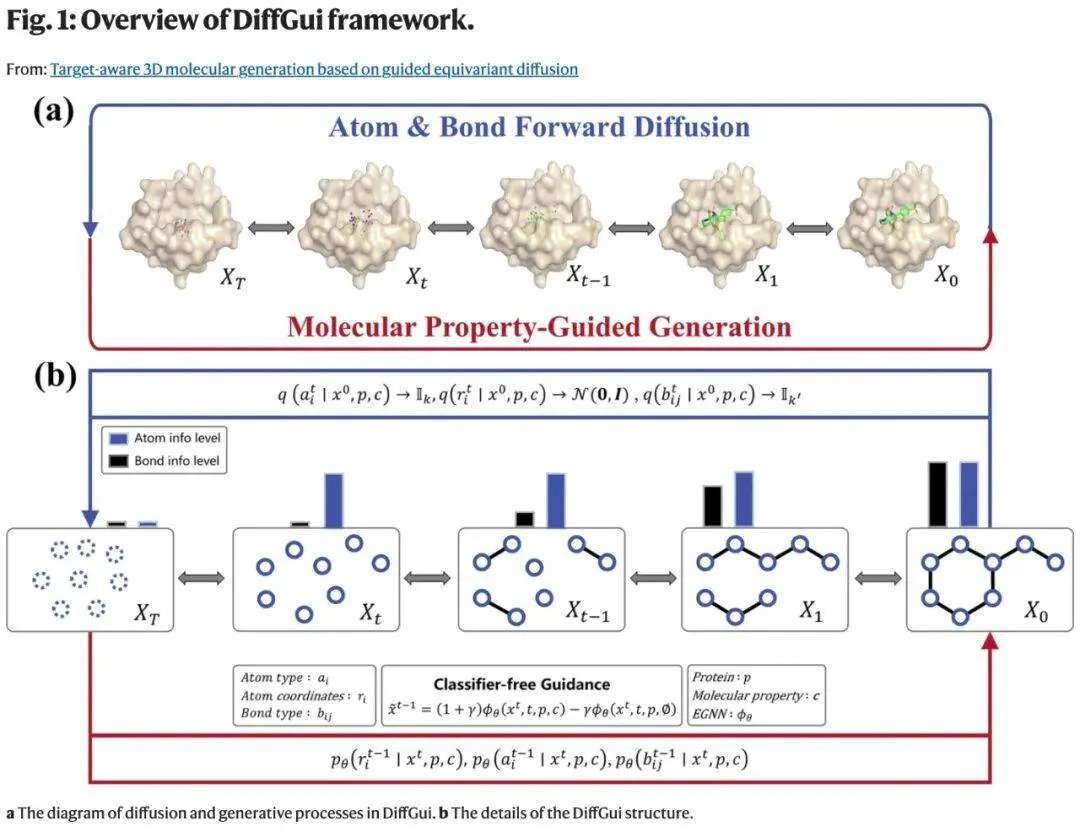
为了实现键扩散与原子扩散的协同,该研究对原子和化学键采用差异化的噪声调度策略,从而有效捕捉原子间距离与化学键类型之间的依赖关系。
该研究还将分子属性标签注入原子特征中,使训练过程转化为条件与非条件建模框架的融合,并引导推理过程生成具有预期属性的分子。
通过采用专门设计的采样算法,DiffGui 能够通过片段生长和骨架跃迁策略进行先导化合物优化。
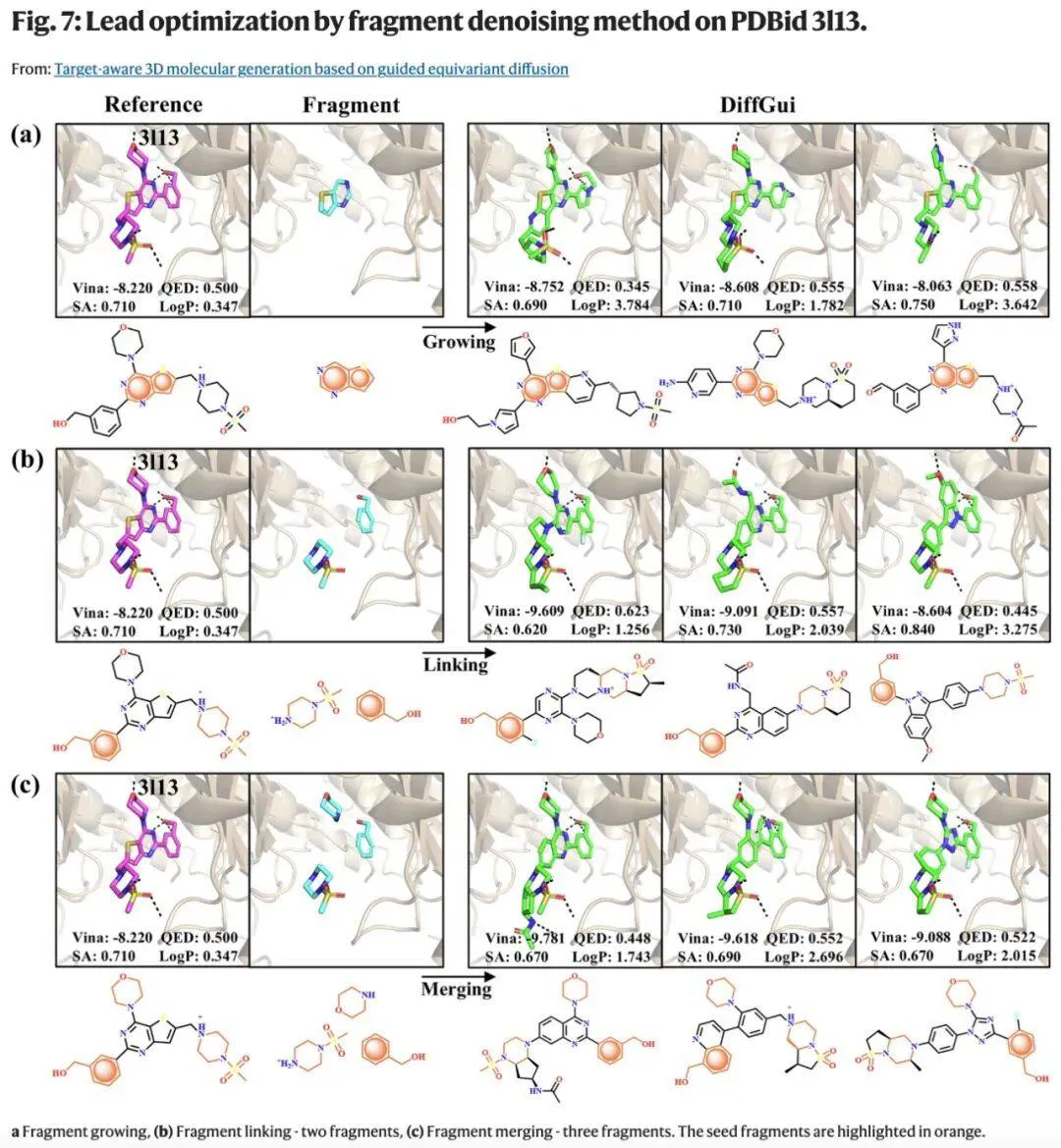
实验评估
为了全面评估模型性能与应用效果,研究团队比较了 DiffGui 与其他 SOTA 方法生成配体的质量、分子指标与属性,并通过消融实验分析键扩散与属性引导模块的作用,最后还通过案例研究展示了 DiffGui 的实用价值。
实验结果表明,DiffGui 在 PDBbind 数据集上达到 SOTA 性能,显著提升了生成分子的质量,其键长、键角、二面角和环状结构比例更接近参考分子。
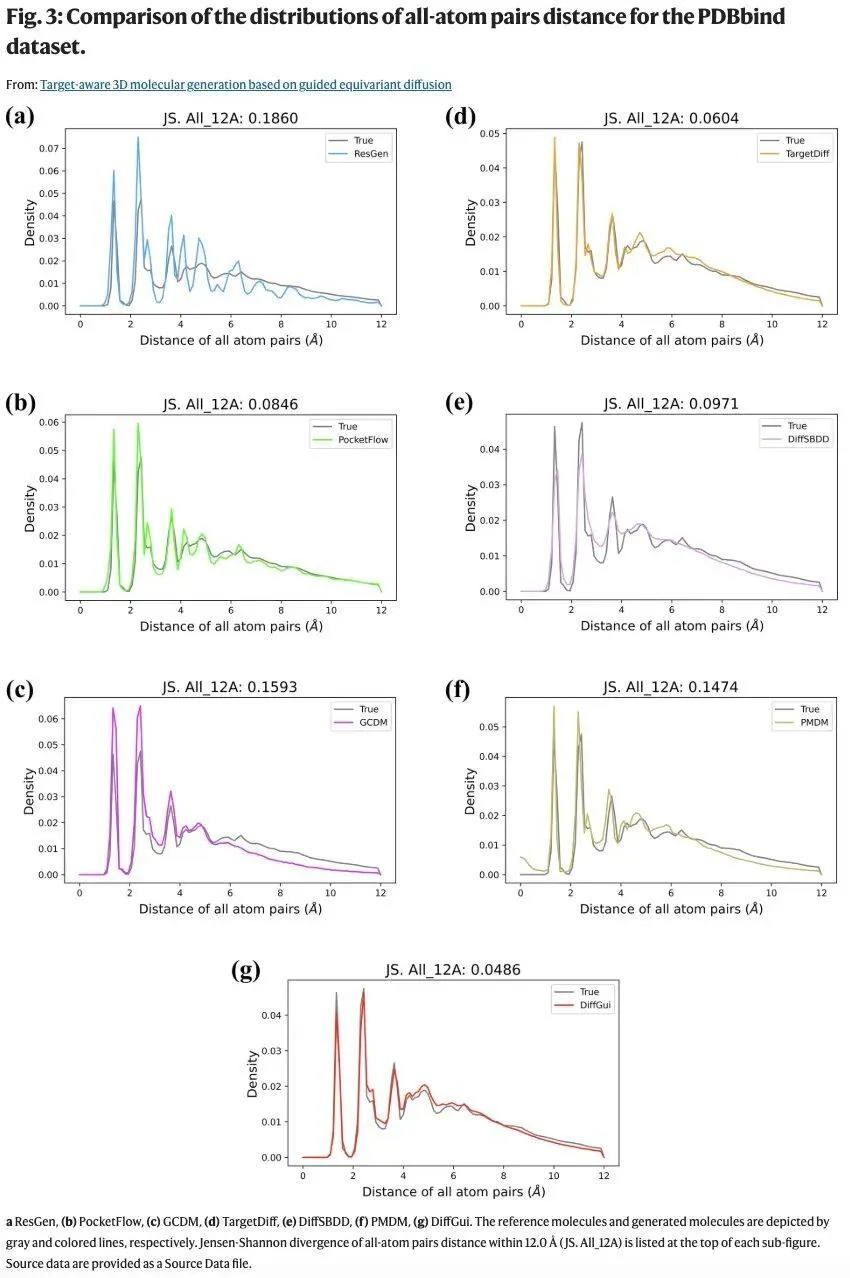
为探究各组件对模型性能的影响,研究团队在 PDBbind 数据集上进行了消融实验,构建了 DiffGui 模型的三个变体:(1)DiffGui-nobond:训练时未采用键扩散过程;(2)DiffGui-nolab:训练时未使用属性标签引导;(3)DiffGui-noboth:同时移除上述两个模块的训练模型。
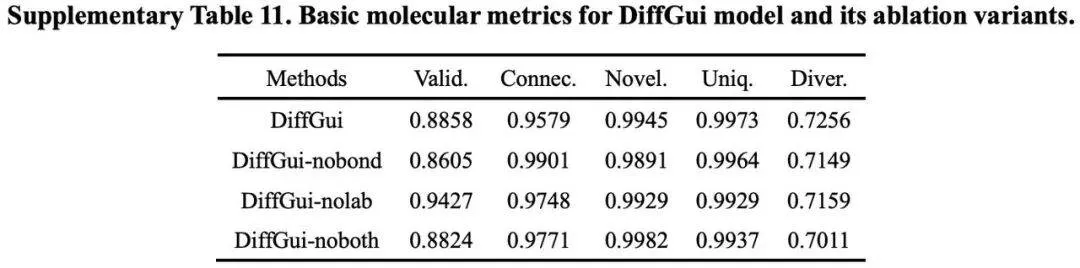
消融实验表明键扩散与属性引导组件能协同生成更真实的分子,同时提升三维结构合理性并优化分子属性。
值得注意的是,DiffGui 的有效性已通过湿实验验证。对野生型和突变型 KRAS 蛋白的案例研究表明,DiffGui 不仅能复现参考复合物中存在的有利相互作用模式,还能敏锐识别蛋白质环境中的细微变化。
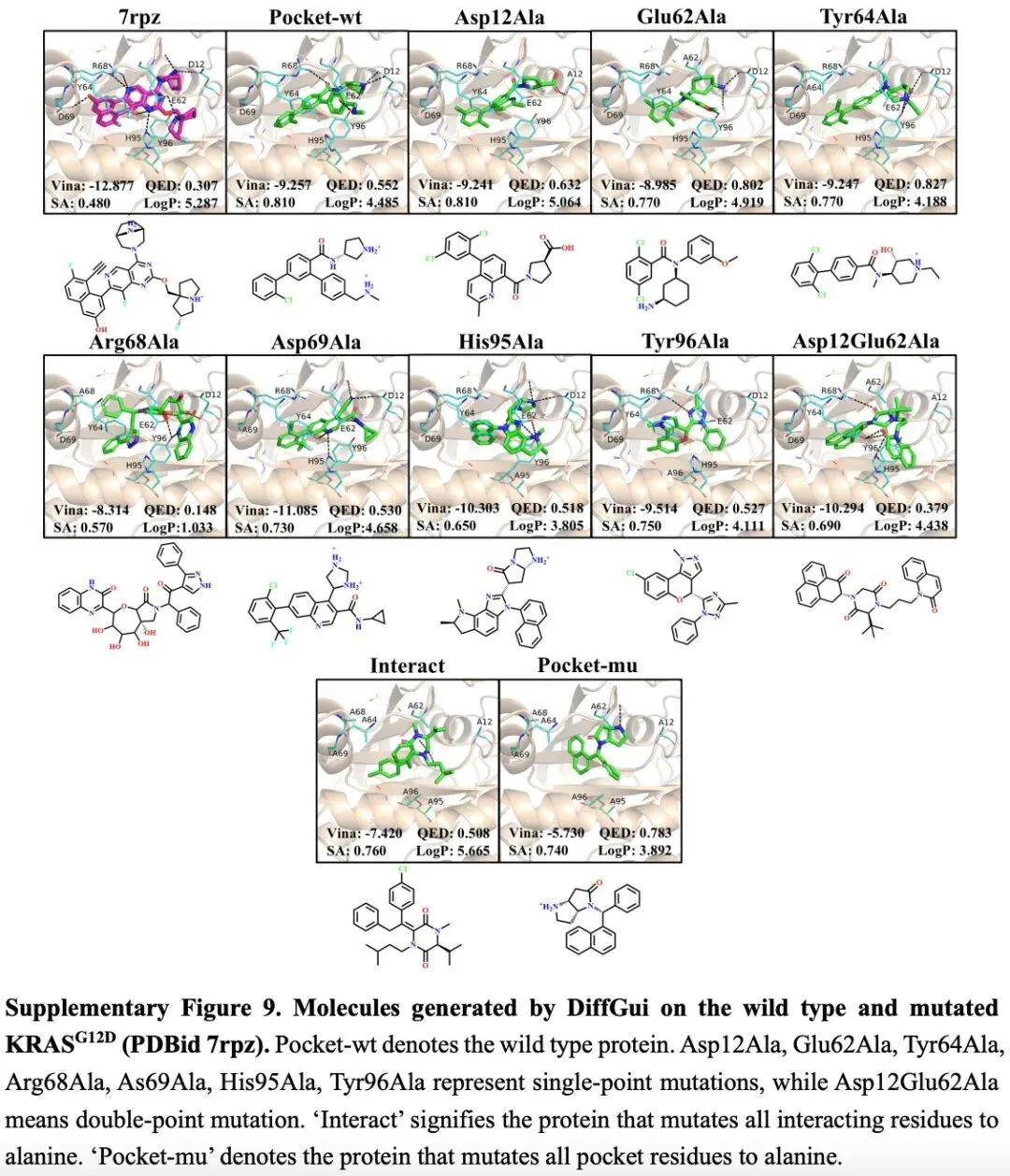
总的来说,DiffGui 能够深刻理解蛋白质 - 配体复合物的几何约束和分子相互作用机制,并提升了对新靶标的泛化能力。
未来,研究团队将基于片段开发靶点感知的分子生成技术,并探索更精细的噪声调度与引导策略,以进一步提升模型性能,最终显著提升药物研发的成功率与效率。
感兴趣的读者可以阅读论文原文,了解更多研究内容。